La Evaluación Clínica Conjunta en la Unión Europea: Un nuevo enfoque en la evaluación de tecnologías sanitarias
La Evaluación Clínica Conjunta (Joint Clinical Assessment, JCA) es una iniciativa fundamental en la Unión Europea (UE) diseñada para optimizar el proceso de evaluación de tecnologías sanitarias (Health Technology Assessment, HTA) mediante un enfoque colaborativo y armonizado entre los Estados miembros.
Esta evaluación sirve para analizar un medicamento en comparación con otras alternativas que ya están en el mercado y tiene como objetivo proporcionar un análisis clínico de alto nivel para nuevas tecnologías sanitarias, facilitando decisiones más informadas, coherentes y transparentes en toda la región.
Las JCA centralizarán los aspectos clínicos de las HTA a nivel de la Unión Europea, mientras que los aspectos no clínicos, como las evaluaciones económicas, continuarán siendo gestionados por los organismos y agencias de evaluación de cada país miembro. Esto busca mantener un equilibrio entre la colaboración regional y las necesidades locales.
El objetivo principal de estas evaluaciones conjuntas es asegurar que las evaluaciones de medicamentos en Europa sean de alta calidad, transparentes y se realicen en plazos oportunos. Esto acelerará el acceso de los pacientes a terapias innovadoras, un factor crucial en el contexto de enfermedades graves como el cáncer y otras condiciones que requieren tratamientos avanzados.
¿Cómo funciona la JCA?
Se estima que el desarrollo del dossier de la Evaluación Clínica Conjunta (JCA) dura aproximadamente 6 meses. El fabricante debe comenzar a preparar el dossier idealmente al presentar la solicitud de autorización de comercialización a la EMA para disponer de tiempo suficiente. El dossier debe presentarse 45 días antes del concepto de la EMA y se publicará, a más tardar, 30 días después de la aprobación del medicamento. Esto podría influir en los procesos de evaluación y negociación de precios específicos de cada país.
La eficacia y seguridad incluidas en el expediente serán los pilares fundamentales sobre los cuales se basará la evaluación, lo que destaca la importancia de contar con parámetros y comparadores clínicamente relevantes para el pagador. En este escenario el Grupo de Coordinación sobre Evaluación de Tecnologías Sanitarias (ETS) en la EMA tiene un papel clave en la definición de los elementos PICO (Pacientes, Intervenciones, Comparadores y Resultados sanitarios) del proceso de evaluación clínica conjunta de medicamentos.
Este grupo, compuesto por representantes de los Estados miembros de la UE, se asegura de que las evaluaciones sean coherentes y basadas en evidencia científica robusta. El evaluador, junto con el co-evaluador, elabora una propuesta de parámetros PICO que se consulta con autoridades nacionales y partes interesadas (incluyendo pacientes y profesionales de la salud).
Durante el proceso, el fabricante debe informar al Grupo de Coordinación sobre nuevos datos clínicos relevantes. Si se modifica la indicación terapéutica inicial durante el procedimiento, se decidirá si la evaluación clínica conjunta debe continuar o reiniciarse. La Comisión Europea actúa como secretaría general del Grupo de Coordinación durante todo el proceso.
Esta reglamentación entrará en vigor en enero de 2025, aplicándose inicialmente a medicamentos oncológicos, terapias celulares y génicas. En 2028, se ampliará para incluir medicamentos huérfanos, y a partir de 2030 se aplicará a todos los medicamentos nuevos.
JCA dossier y presentación de información
La primera sección del dossier debe incluir información administrativa sobre el fabricante responsable de la tecnología de interés y un resumen ejecutivo del contenido, enfocándose en el alcance de la evaluación y la respuesta a los criterios PICO.
A continuación, se proporciona un análisis de la condición de salud, la población objetivo, el tratamiento clínico actual, las diferencias entre países, la caracterización de la tecnología médica y su estado regulatorio. La sección de métodos describe los criterios para seleccionar estudios y la recopilación de información.
Luego, se presentan los resultados de efectividad y seguridad relativos y las respuestas a cada pregunta PICO basada en la población de pacientes y características específicas. Finalmente, se incluyen la documentación subyacente y un resumen del documento completo.
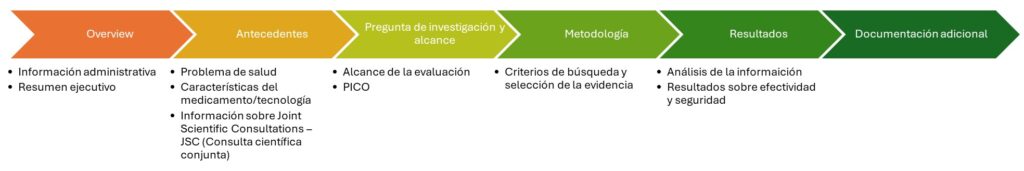
Figura 1. Descripción general del contenido del expediente de presentación de la JCA
Impacto y retos en el sector farmacéutico
La implementación de la JCA tendrá múltiples efectos positivos en el sector farmacéutico, incluyendo una aceleración en el acceso al mercado de nuevas tecnologías sanitarias, lo que beneficiará a las empresas farmacéuticas al facilitar la comercialización de innovaciones médicas. Además, se espera una reducción en los costos y la duplicación de esfuerzos, tanto para las compañías farmacéuticas como para las agencias de HTA.
Asimismo, la JCA mejorará la calidad de las evaluaciones al involucrar a expertos de diferentes países, fomentando la colaboración internacional y garantizando que las decisiones sobre la adopción y el reembolso de nuevas tecnologías se basen en la mejor evidencia disponible. Esto aumentará la confianza en los procesos de evaluación, tanto a nivel clínico como económico.
Sin embargo, con estos beneficios también se presentan desafíos importantes. Uno de los mayores retos es la armonización de los métodos de evaluación clínica entre los diferentes Estados miembros. Las agencias de HTA deberán colaborar estrechamente para establecer criterios y estándares comunes que aseguren la coherencia y comparabilidad de las evaluaciones. Además, la rápida evolución de la tecnología médica implica que las agencias deberán estar preparadas para adaptarse a los avances y garantizar que las evaluaciones sigan siendo relevantes y precisas.
Lecciones para América Latina y Colombia
La experiencia europea con la JCA ofrece valiosas lecciones para América Latina y Colombia. La colaboración entre países y la armonización de métodos de evaluación pueden mejorar significativamente la eficiencia y la calidad de las evaluaciones clínicas. Adoptar un enfoque de evaluación conjunta en la región podría no solo aumentar la transparencia y la consistencia en las decisiones de HTA, sino también facilitar el acceso a tratamientos innovadores, mejorando los resultados de salud y reduciendo las desigualdades en el acceso a medicamentos avanzados.
More information
- Navigating market access pathways across European Union markets in 2025 and beyond
- Joint Clinical Assessment (JCA)
- La Comisión facilita un acceso más rápido a los medicamentos con normas claras para las evaluaciones clínicas conjuntas
- Commission Implementing Regulation (EU) 2024/1381 of 23 May 2024