Evaluación de tecnologías sanitarias para la terapia génica y celular. Todo lo que debe saber
La terapia génica y celular ha emergido como un campo revolucionario en la medicina, brindando esperanza para el tratamiento de enfermedades hereditarias y adquiridas. Sin embargo, la implementación segura y efectiva de estas tecnologías innovadoras requiere una rigurosa evaluación. En este blog, exploraremos los puntos clave de la evaluación de tecnologías para terapia génica y celular.
La evaluación de la terapia génica y la terapia celular ha revolucionado el campo de la medicina y la biotecnología en las últimas décadas. Estos enfoques terapéuticos vanguardistas tienen el potencial de tratar y, en algunos casos, incluso curar enfermedades genéticas y otras afecciones crónicas que antes se consideraban intratables.
Con respecto a la terapia génica, esta se basa en la introducción de material genético funcional en células o tejidos defectuosos para corregir o reemplazar genes defectuosos. Estas terapias utilizan una variedad de técnicas, como vectores virales o sistemas de edición genética. Por su parte, la terapia celular se basa en la administración de células vivas o modificadas al organismo para restaurar la función celular defectuosa o promover la regeneración de tejidos dañados. Estas células pueden ser extraídas del propio paciente (terapia celular autóloga) o de donantes (terapia celular alogénica) y se utilizan para tratar una amplia gama de enfermedades, como el cáncer, las lesiones de la médula espinal o las enfermedades autoinmunes, tal y como se profundizó en nuestro pasado blog: “Retos y aspectos claves en el acceso a la terapia génica y a medicamentos innovadores, ¿cómo abordarlos?”[1].
La evaluación de estas tecnologías es un proceso riguroso de vital importancia para garantizar la seguridad y eficacia de estos enfoques terapéuticos, por lo cual es necesario explorar los desafíos y avances en la evaluación de la terapia génica y la terapia celular, examinando los diferentes aspectos que influyen en la seguridad, eficacia y accesibilidad de estas estrategias terapéuticas (Figura 2). Así como, los dilemas éticos y las consideraciones regulatorias que surgen en el camino hacia la implementación generalizada, ya que comprender plenamente la evaluación de la terapia génica y la terapia celular, permite cuantificar su potencial impacto en la medicina moderna y visualizar un futuro para las enfermedades genéticas y crónicas.
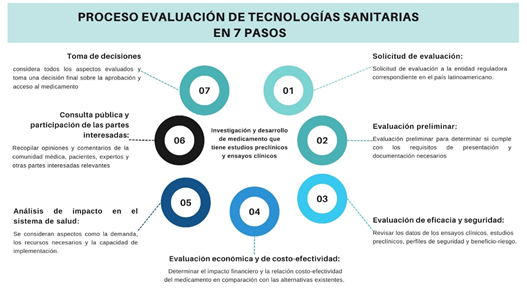
Figura 2. 7 pasos para llevar a cabo la evaluación de tecnologías sanitarias. Elaboración propia.
Por otro lado, la evaluación de tecnologías sanitarias (HTA, por sus siglas en inglés) es un proceso sistemático utilizado para evaluar la seguridad, eficacia, efectividad, impacto clínico y económico de una tecnología de salud, como la terapia génica y celular. Este enfoque busca proporcionar información objetiva y basada en evidencia para respaldar la toma de decisiones informadas sobre la adopción, el uso y la financiación de estas tecnologías. En el caso de la terapia génica y celular, la HTA juega un papel fundamental para evaluar y comparar estas tecnologías con los tratamientos existentes o el cuidado estándar, por lo que, se consideran varios aspectos durante la evaluación HTA, como la seguridad y eficacia clínica, la calidad de vida de los pacientes, la durabilidad de los efectos terapéuticos, el impacto en el sistema de salud y los costos asociados (Tabla 1).
| Tipo de estudio | Objetivo o resultado esperado |
| Evaluación de costo-efectividad | Se utilizan para comparar intervenciones o tecnologías en salud que tienen un desenlace clínico en común. Se presentan los resultados mediante la Razón Incremental de costo-efectividad. En Colombia, el Decreto 710 de 2018 en el artículo 2.8.12.7 menciona que no es necesaria la evaluación de costo-efectividad para la evaluación de medicamentos nuevos para enfermedades huérfanas, sólo comprenderá la clasificación de valor terapéutico y el análisis de impacto presupuestal. |
| Análisis de costo-utilidad | El propósito es medir los beneficios de acuerdo con las preferencias de las personas por diferentes estados de salud, es decir, una aproximación a la utilidad. Esta se define como el beneficio en salud percibido obtenido usando una tecnología en salud. En estas evaluaciones la medida más frecuentemente utilizada es el Año de Vida Ajustado por Calidad (AVAC). |
| Evaluaciones de costo-beneficio | Las evaluaciones de costo-beneficio se caracterizan porque tanto los costos como los beneficios se miden en términos monetarios. Es difícil convertir los beneficios producidos por una intervención en salud a términos monetarios. |
| Evaluaciones de costo-minimización | Se consideran solo los costos de las alternativas a evaluar y se asume que los beneficios de las diferentes alternativas son equivalentes. Rara vez los beneficios obtenidos con el uso de dos tecnologías en salud son realmente equivalentes. Por esta razón, este tipo de evaluación tampoco se utiliza con tanta frecuencia. |
| Evaluación de efectividad y seguridad | Evaluar la eficacia y la seguridad de una tecnología sanitaria en un entorno clínico. Determinar si la tecnología produce los resultados esperados y si es segura para su uso en los pacientes. |
| Evaluación de implementación y viabilidad técnica | Evaluar los desafíos y las estrategias para implementar una tecnología sanitaria en el sistema de atención médica. Identificar barreras y facilitadores de la adopción exitosa de la tecnología y determinar si la tecnología puede implementarse de manera efectiva y eficiente en un entorno de atención médica. |
Tabla 1. Tipos de evaluación de tecnologías sanitarias. Fuente: Claves para entender los análisis de costo-efectividad y otros tipos de evaluaciones económicas https://neuroeconomix.com/es/claves-para-entender-los-analisis-de-costo-efectividad-y-otros-tipos-de-evaluaciones-economicas
Las entidades responsables de llevar a cabo la evaluación HTA pueden variar según el país o la región. En algunos casos, los gobiernos cuentan con agencias o comités especializados en HTA que analizan y emiten recomendaciones sobre la incorporación de tecnologías de salud en los sistemas de salud. También existen organizaciones internacionales, como la Agencia de Evaluación de Tecnologías Sanitarias de la Unión Europea (EUnetHTA) y el Institute for Clinical and Economic Review (ICER) en los Estados Unidos, que realizan evaluaciones HTA a nivel regional o nacional.
En el contexto de Latinoamérica, varios países han establecido programas y agencias de HTA para evaluar y tomar decisiones informadas sobre la adopción de nuevas tecnologías de salud (Tabla 2). Estas evaluaciones pueden considerar tanto la eficacia clínica como los aspectos económicos y de impacto en el sistema de salud. Sin embargo, la disponibilidad y el alcance de la HTA pueden variar entre países y es posible que algunos aún estén desarrollando sus capacidades en este campo, por lo cual se espera que esta evaluación se fortalezca y se expanda en la región a medida que se desarrollen las capacidades y se reconozca su importancia en la toma de decisiones en salud.
| País | Entidad reguladora | Tiempo aproximado del proceso |
| Argentina | Agencia de Evaluación de Tecnologías Sanitarias (AGNET) | 9 a 12 meses |
| Brasil | Comisión Nacional de Incorporación de Tecnologías en el Sistema Único de Salud (CONITEC) | 6 a 12 meses |
| Chile | Comisión de Evaluación de Tecnologías de Salud (CETS) | Variable, según el tipo de tecnología y contexto |
| Colombia | Instituto de Evaluación Tecnológica en Salud (IETS) | Variable, según el tipo de tecnología y contexto |
| Costa Rica | Agencia de Evaluación de Tecnologías en Salud (AGATES) | Variable, según el tipo de tecnología y contexto |
| México | Centro Nacional de Excelencia Tecnológica en Salud (CENETEC) | Variable, según el tipo de tecnología y contexto |
| Perú | Instituto de Evaluación, Tecnología e Innovación en Salud (IETSI) | Variable, según el tipo de tecnología y contexto |
Tabla 2. Entidades regulatorias de Latinoamérica y tiempo aproximado del proceso de evaluación de tecnologías sanitarias. Fuente: Sistema de Evaluación de Autoridades Reguladoras Nacionales de Medicamentos-https://www3.paho.org/hq/index.php?option=com_content&view=article&id=1615:2009-sistema-evaluacion-autoridades-reguladoras-nacionales-medicamentos&Itemid=0&lang=es#gsc.tab=0
Sin embargo, las limitaciones de las HTA no solo se encuentran en Latinoamérica. A nivel mundial, estas evaluaciones permiten identificar y comprender los riesgos potenciales asociados con estas tecnologías y garantizar que se sigan los estándares de seguridad más altos. Al obtener una visión clara de los beneficios y riesgos, las HTA ayudan a los profesionales de la salud y a los responsables de políticas a tomar decisiones informadas y a mejorar la calidad de la atención médica. Al mismo tiempo, las HTA consideran los aspectos económicos, como los costos directos e indirectos de la terapia, el impacto en los recursos de atención médica y la relación costo-efectividad en comparación con las alternativas existentes. Esta información es fundamental para garantizar la asignación adecuada de recursos limitados y lograr una atención médica eficiente y sostenible.
A pesar de los beneficios, las evaluaciones de tecnologías sanitarias también enfrentan varios desafíos en la actualidad. Uno de los desafíos es la rápida evolución de la terapia génica y celular, lo que puede dificultar la recopilación de evidencia sólida y actualizada, ya que estas tecnologías son relativamente nuevas y continúan en desarrollo, puede ser un desafío evaluar su eficacia y seguridad a largo plazo, así como su impacto en diferentes subgrupos de pacientes, tal y como se evidencia en la figura 2 donde dadas las limitaciones se proponen modificaciones clave en la evaluación de tecnologías para un mejor funcionamiento.
Otro desafío es la complejidad de la terapia génica y celular, que a menudo involucra múltiples componentes y etapas, desde la modificación genética hasta la administración de células o vectores. Esta complejidad puede plantear desafíos en términos de estandarización, control de calidad y reproducibilidad, lo que dificulta la evaluación y comparación de diferentes tecnologías. Además, las HTA deben abordar las consideraciones éticas y sociales relacionadas con la terapia génica y celular. Esto implica evaluar cuestiones como la equidad en el acceso a estas tecnologías, el consentimiento informado, la privacidad de los datos genéticos y la aceptación pública de las terapias que implican modificaciones genéticas.

Figura 2. Puntos por mejorar, fortalecer y ventajas de las evaluaciones de tecnologías sanitarias de terapias génicas y terapia celular. Elaboración propia.
Así mismo, es de suma importancia abordar la incertidumbre que surge debido a la novedad de estas terapias y, la falta de datos a largo plazo sobre su eficacia y seguridad, así como los desafíos económicos o logísticos relacionados con su implementación. Por lo cual, al evaluar rigurosamente la evidencia disponible, las HTA ayudan a reducir la incertidumbre al proporcionar una evaluación objetiva y basada en evidencia sobre la eficacia, seguridad y costo-efectividad de las terapias génicas y celulares, brindando herramientas para resolver a fondo la incertidumbre en el acceso a las terapias innovadoras, no obstante, esto se abordará en un próximo blog.
En conclusión, acá dejamos algunos puntos importantes a tener en cuenta con respecto a la evaluación de tecnologías de terapias génicas y celulares:
- Las evaluaciones de tecnologías sanitarias desempeñan un papel crucial al evaluar la terapia génica y celular, permitiendo determinar su eficacia, seguridad y valor clínico.
- Estas evaluaciones enfrentan desafíos debido a la rápida evolución de estas tecnologías, su complejidad y las implicaciones éticas y sociales asociadas.
- Para superar estos desafíos, es necesario adoptar un enfoque multidisciplinario que involucre a expertos en genética, medicina, ética, economía de la salud y otros campos relevantes.
- Además, se requiere una estrecha colaboración entre los diferentes actores involucrados, como agencias reguladoras, profesionales de la salud, pacientes y la industria farmacéutica.
- Es esencial desarrollar y actualizar constantemente los métodos y marcos de evaluación para adaptarse a las innovaciones en terapia génica y celular, asegurando que reflejen adecuadamente su naturaleza única y su potencial impacto en la salud pública.
- Las evaluaciones de tecnologías sanitarias desempeñan un papel fundamental en garantizar la adopción adecuada y el uso seguro y efectivo de la terapia génica y celular, contribuyendo así a mejorar los resultados clínicos y la calidad de vida de los pacientes.
- Al hacerlo, se promueve la equidad en el acceso a estas terapias y se optimiza la asignación de recursos de salud, en beneficio tanto de los pacientes como de la sociedad en general.
- El blog se encuentra en la siguiente dirección electrónica: https://neuroeconomix.com/es/retos-y-problemas-presentes-en-el-acceso-a-los-productos-biologicos-y-a-los-medicamentos-innovadores-como-abordarlos/
Referencias:
- Coyle, Doug, Isabelle Durand-Zaleski, Jasmine Farrington, Louis Garrison, Johann-Matthias Graf von der Schulenburg, Wolfgang Greiner, Louise Longworth, et al. 2020a. “HTA Methodology and Value Frameworks for Evaluation and Policy Making for Cell and Gene Therapies.” The European Journal of Health Economics: HEPAC: Health Economics in Prevention and Care 21 (9): 1421–37.
- “HTA Methodology and Value Frameworks for Evaluation and Policy Making for Cell and Gene Therapies.” The European Journal of Health Economics: HEPAC: Health Economics in Prevention and Care 21 (9): 1421–37.
- Ministerio de salud de Colombia “Dirección General de Calidad de Herramientas Innovadoras Para Colombia, Proyecto: Diseño Y/o Adaptación; de Gestión Clínica Y/o Administrativa, de Mejores Prácticas Inter- Nacionales; de La Calidad de La Atención En Salud., Para Que Los Hospitales Mejoren Su Desempeño Frente a Los Estándares Del Sistema Único de Acreditación Y El Componente de Auditoría Para El Mejoramiento.” https://www.minsalud.gov.co/sites/rid/1/Guia_evalucaion_de_tecnoclogias_en_salud.pdf.
- Drummond, Michael, Oriana Ciani, Giulia Fornaro, Claudio Jommi, Eva Susanne Dietrich, Jaime Espin, Jean Mossman, and Gerard de Pouvourville. 2023. “How Are Health Technology Assessment Bodies Responding to the Assessment Challenges Posed by Cell and Gene Therapy?” BMC Health Services Research 23 (1): 484.
- “Evaluación de tecnologías de salud.” Organización Panamericana de la salud. Accessed June 28, 2023. https://www.paho.org/es/temas/evaluacion-tecnologias-salud.
- Eve Hanna, Mondher Toumi. 2020. “Gene and Cell therapies_Market Access and Funding.”
- “Gene Therapy: International Regulatory and Health Technology Assessment (HTA) Activities and Reimbursement Status.” n.d. Accessed June 28, 2023. https://www.cadth.ca/gene-therapy-international-regulatory-and-health-technology-assessment-hta-activities-and.
- Ham, Renske M. T. ten, Geert W. J. Frederix, Olivia Wu, Wim Goettsch, Hubert G. M. Leufkens, Olaf H. Klungel, and Jarno Hoekman. 2022. “Key Considerations in the Health Technology Assessment of Advanced Therapy Medicinal Products in Scotland, The Netherlands, and England.” Value in Health: The Journal of the International Society for Pharmacoeconomics and Outcomes Research 25 (3): 390–99.
- “Health Technology Assessment of Gene Therapies: Are Our Methods Fit for Purpose?” 2022. OHE. January 6, 2022. https://www.ohe.org/publications/health-technology-assessment-gene-therapies-are-our-methods-fit-purpose/.
- Pochopień, Michał, Ewelina Paterak, Emilie Clay, Justyna Janik, Samuel Aballea, Małgorzata Biernikiewicz, and Mondher Toumi. 2021. “An Overview of Health Technology Assessments of Gene Therapies with the Focus on Cost-Effectiveness Models.” Journal of Market Access & Health Policy 9 (1): 2002006.
- “Proceso de evaluación de tecnologías sanitarias: fundamentos.” 2015. EUPATI Toolbox. November 23, 2015. https://toolbox.eupati.eu/resources/proceso-de-evaluacion-de-tecnologias-sanitarias-fundamentos/?lang=es.
- Decreto 710 de 2018 https://www.funcionpublica.gov.co/eva/gestornormativo/norma.php?i=85982






