Los nuevos horizontes de la Política Farmacéutica en Colombia: Análisis de la Circular 018 de 2024
La regulación de precios de medicamentos es una piedra angular en los sistemas de salud para garantizar que los tratamientos esenciales sean accesibles y asequibles para la población, evitando así barreras económicas que puedan impedir la atención adecuada. Las estrategias de regulación de precios en el mundo y en Colombia han variado desde precios máximos impuestos por el gobierno hasta esquemas de libertad vigilada, donde los precios se ajustan con base a la competencia y las condiciones del mercado.
En el escenario internacional, la referenciación internacional de precios de medicamentos es una práctica que compara los precios de un medicamento en diferentes países para establecer un precio de referencia que pueda aplicarse de manera justa y equitativa. Este método permite a los reguladores obtener una perspectiva global y tomar decisiones informadas basadas en el comportamiento de los precios a nivel internacional.
La regulación de precios de medicamentos en Colombia basada en la referenciación internacional de precios, inició con la Circular 03 de 2013, donde se diferenciaron los regímenes de libertad vigilada y el régimen de control directo, con su respectiva metodología de cálculo. Esta regulación se fundamentó en metodologías de comparación internacional y controles específicos sobre los precios más altos en el mercado, buscando equilibrar el acceso y la sostenibilidad del sistema de salud.
Desde entonces, ha habido actualizaciones significativas para refinar este proceso, como la reciente Circular 018 de 2024. La evolución de esta política refleja un esfuerzo constante por parte del gobierno colombiano para mantener los medicamentos a precios razonables y accesibles para toda la población.
La reciente Circular 018 de 2024 (1) introduce cambios sustanciales en la regulación de precios de medicamentos en Colombia, buscando actualizar y precisar los mecanismos de control. A continuación, desglosamos los aspectos clave de esta nueva normativa:
- Mercados relevantes
Uno de los cambios introducidos por esta circular es la clasificación del mercado relevante de los medicamentos definida en el Artículo 14 de la Circular, que ahora considera dos atributos esenciales para su definición: la “participación de ventas” y la “concentración del mercado relevante”. Esta clasificación determinará si un medicamento se rige por un régimen de control directo (Grupo A) o se mantiene bajo libertad vigilada (Grupo B), como lo describe el artículo 15:
“Artículo 15. Puntaje final e incorporación o exclusión de un mercado relevante del control directo de precio. El puntaje final de cada mercado relevante se calculará sumando los puntajes obtenidos de los dos criterios de los que trata el artículo 14 de la presente circular. Una vez se obtenga el puntaje final, el mercado relevante será clasificado en uno de los siguientes grupos:
15.1. Grupo A. Si el puntaje final se encuentra entre 5 y 8, el mercado relevante debe incluirse o mantenerse en el régimen de control directo de precio.
15.2. Grupo B. Si el puntaje final se encuentra entre 2 y 4, el mercado relevante será excluido del régimen de control directo de precio y pasará al régimen de libertad vigilada.”
La circular 018 aclara que los Medicamentos Vitales No Disponibles (MVND), se incluirán automáticamente en el Grupo A. Esta aclaración cobra especial relevancia en el contexto actual de Colombia, donde anteriormente los medicamentos declarados en desabastecimiento podían ingresar al país como MVND quedando excluidos de cualquier regulación de precio.
- Precios de Referencia
En cuanto al Precio de Referencia Nacional (PRN), este se sitúa ahora en el percentil 90, representando un cambio en el cálculo basado en las condiciones del mercado local.
La metodología para determinar el Precio Base (PB) también ha evolucionado.
1.Para mercados con un solo oferente, el PB se fija entre el precio del oferente y el percentil 20 del Precio de Referencia Internacional (PRI)
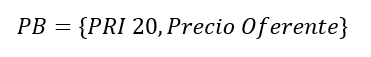
2.En mercados con múltiples oferentes, se toma como PB el precio más bajo entre el PRN y el PRI 20.
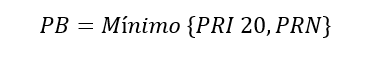
Cabe señalar la exclusión de Argentina y Uruguay de la lista de países de referencia y la especificación de que el PRI debe provenir del mismo medicamento comercializado por el mismo fabricante o marca en el exterior, aplicándose un porcentaje de ajuste si el precio de referencia es de otro producto. La lista actualizada de países de referencia es: Alemania, Australia, Brasil, Canadá, Chile, Ecuador, España, Estados Unidos, Francia, Grecia, India, Italia, México, Noruega, Panamá, Perú, Portugal, Reino Unido y Sudáfrica.
- Precio Máximo de Venta:
De acuerdo con la circular, el Precio Máximo de Venta (PMV) se determina adicionando al precio base un margen de ajuste. El margen de ajuste (MA) es definido como un margen de comercialización que puede ser basado en información nacional o internacional (siempre y cuando no exista información del margen de comercialización nacional).
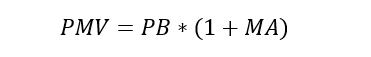
Si el actor que realiza la transacción final institucional es una Institución Prestadora de Servicios de Salud (IPS), el PMV incorporará adicionalmente el “Margen para Instituciones Prestadoras de Servicios de Salud (IPS)” (Artículo 11).

La Circular 018 de 2024 es un paso en la continua evolución de la regulación de precios de medicamentos en el país, que busca refinar y actualizar los mecanismos de control de precios de medicamentos en el mercado. Con la introducción de nuevas metodologías y aclarando criterios y vacíos de la regulación anterior, pretendiendo de esta forma asegurar una estructura coherente y transparente para la determinación de precios. Con este esfuerzo normativo, Colombia continua la tarea de adecuarse a estándares internacionales y satisfacer las expectativas nacionales en cuanto al acceso a los medicamentos.
Referencias
- Comisión Nacional de Precios de Medicamentos y Dispositivos Médicos. Circular 18 de 2024 [Internet]. 2024. Available from: https://www.minsalud.gov.co/sites/rid/Lists/BibliotecaDigital/RIDE/DE/DIJ/circular-018-de-2024.pdf






Cordial Saludo
De acuerdo con lo que manifiestas aquí me nacen unas preguntas, algunos de los medicamentos que se encontraban en control directo de precios salen de este control y entran en libertad vigilada?
o eso solo aplicaría para medicamentos que recién van a ser sometidos?
Quedo atento
Estimado Andrés, gracias por leernos, la Circular 18 de 2024 establece en su artículo 27 lo siguiente: “Transitoriedad. Las circulares que contienen precios máximos de venta emitidas con base en la metodología de la Circular 03 de 2013 mantendrán su vigencia hasta cuando sean actualizados conforme al artículo 23 de la presente circular.” Por lo tanto, ante tu pregunta, si el medicamento se encontraba regulado con la metodología anterior, permanecerá así hasta su actualización. En cualquier caso, para situaciones puntuales siempre es recomendable consultar directamente a la Comisión de precios, ya que en la misma circular se indica que en casos excepcionales y bajo solicitud de los interesados, la secretaría técnica puede revisar los precios base (Art 23, parágrafo 2).